Tous les gènes n’évoluent pas à la même vitesse. Les plus importants évoluent généralement plus lentement. En fait, la vitesse à laquelle les gènes accumulent des mutations est dictée par l'intensité de la pression de sélection à laquelle ils sont soumis.
 Le mois dernier, nous avons vu que les gènes peuvent être utilisés pour retracer les relations évolutives des espèces. Ce mois-ci, nous allons voir comment et pourquoi ils peuvent aussi servir à dater le temps du dernier ancêtre commun des espèces.
Le mois dernier, nous avons vu que les gènes peuvent être utilisés pour retracer les relations évolutives des espèces. Ce mois-ci, nous allons voir comment et pourquoi ils peuvent aussi servir à dater le temps du dernier ancêtre commun des espèces.
Comment?
En 1962, Emile Zuckerkandl et Linus Pauling ont remarqué que les mutations des gènes codant pour l’hémoglobine, une protéine des globules rouges, s'accumulaient à une vitesse proportionnelle au temps géologique.
L'hypothèse de l'horloge moléculaire était née! Cette thèse fut initialement très controversée parce que plusieurs chercheurs ne comprenaient pas comment les mutations pouvaient s’accumuler non seulement à un taux constant, mais aussi chez des espèces aux modes de vie très différents.
Des études subséquentes ont démontré que cette hypothèse se vérifiait. Prenons le graphique ci-dessous, qui montre le pourcentage de différences entre les protéines de certaines espèces. Il est adapté à partir des données de l’étude de Langley et Fitch (1974) et est basé sur des séquences protéiques d’hémoglobines, de cytochrome C et de fibrinopeptide A.
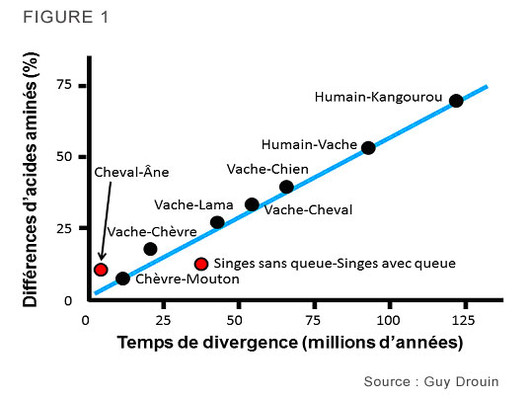 On voit que pour la plupart des comparaisons (points noirs), les mutations s'accumulent à une vitesse proportionnelle au temps géologique. Ici, le taux d’évolution moyen est de 0,3 % par million d’années. En fait, la comparaison chèvre-mouton (7 % divisé par 14 millions d’années; les chèvres et les moutons ayant évolué indépendamment pendant 7 millions d’années depuis leur dernier ancêtre commun) et la comparaison humain-kangourou (70 % divisé par 240 millions d’années; les humains et les kangourous ayant évolué séparément pendant 120 millions d’années) donnent toutes deux un taux d’évolution de 0,3 % par million d’années.
On voit que pour la plupart des comparaisons (points noirs), les mutations s'accumulent à une vitesse proportionnelle au temps géologique. Ici, le taux d’évolution moyen est de 0,3 % par million d’années. En fait, la comparaison chèvre-mouton (7 % divisé par 14 millions d’années; les chèvres et les moutons ayant évolué indépendamment pendant 7 millions d’années depuis leur dernier ancêtre commun) et la comparaison humain-kangourou (70 % divisé par 240 millions d’années; les humains et les kangourous ayant évolué séparément pendant 120 millions d’années) donnent toutes deux un taux d’évolution de 0,3 % par million d’années.Donc, si vous comparez les séquences protéiques d’hémoglobines de cytochrome C et de fibrinopeptide A des rats et des souris et que vous calculez que leurs protéines ont accumulé 24 % de différences, vous pourriez conclure que ces deux espèces ont eu leur dernier ancêtre commun il y a 40 millions d’années (24/0,3 = 80 et 80/2 = 40).
Voilà la beauté de l’horloge moléculaire! On peut calculer des temps de divergence sans avoir besoin des fossiles. On se sert simplement d’une calibration déduite à partir des gènes ou protéines d’autres espèces.
Les exceptions
Il y a cependant des exceptions (points rouges). Par exemple, il y a eu accélération du taux de mutation chez les équidés, car ils auraient accumulé 7 % de différences en seulement 2 millions d’années plutôt qu’en 10 millions d’années si le taux de mutation avait été celui de la ligne bleue. Cette accélération s’est produite chez les ânes. Il y a aussi eu une diminution du taux de mutation chez les singes : 33 millions d’années ont été nécessaires pour accumuler 10 % de différences, plutôt que 20 millions d’années si le taux de mutation avait été celui de la ligne bleue. Cette diminution s’est produite chez les singes sans queue (incluant les humains).
Les ratés de l’horloge moléculaire
Plusieurs hypothèses ont été suggérées pour expliquer ces exceptions. Le temps de génération, par exemple, influence parfois l’horloge moléculaire. En effet, les espèces ayant un temps de génération plus court accumulent, règle générale, les mutations plus rapidement, leur ADN étant répliqué plus souvent.
Des différences dans la fidélité de réplication de l’ADN peuvent aussi expliquer les variations. Certaines espèces ont des enzymes de réplication moins efficaces accumulant plus de mutations. Des différences dans l’efficacité des systèmes de réparation de l’ADN sont une autre explication.
Finalement, les taux métaboliques peuvent aussi être responsables des variations dans l’horloge moléculaire des gènes mitochondriaux. Les espèces ayant des taux métaboliques plus élevés accumulent plus de mutations dues à l’effet mutagène des radicaux d’oxygène produits pendant la respiration aérobique à l’intérieur les mitochondries.
Les aiguilles de l’horloge moléculaire
Tous les gènes n’évoluent pas à la même vitesse. Les plus importants évoluent généralement plus lentement. En fait, la vitesse à laquelle les gènes accumulent des mutations est dictée par l'intensité de la pression de sélection à laquelle ils sont soumis. Pour mesurer les temps de divergence, il faut donc utiliser des gènes qui évoluent à un taux approprié. Comme avec une horloge mécanique, on va donc utiliser la trotteuse des secondes (taux de mutation élevés, par exemple un gène non fonctionnel ou un gène mitochondrial) pour des évènements récents, l'aiguille des minutes (taux de mutation moyens, par exemple les gènes codant pour les hémoglobines qui transportent l’oxygène dans notre sang) pour l'analyse d'un passé proche et l'aiguille des heures (taux de mutation faibles, par exemple le gène codant pour l’actine, une des deux protéines principales de nos muscles) pour l'étude d'un passé lointain.
Pourquoi?
Malgré ses ratés, le graphique ci-dessus démontre que l’horloge moléculaire fonctionne généralement bien. Pourquoi? Parce qu’elle « tic-tac » aux mutations neutres! En effet, s’il n’y avait que des mutations avantageuses et des mutations désavantageuses, il n’y aurait pas d’horloge moléculaire parce que toutes les espèces accumuleraient des mutations à des taux différents.
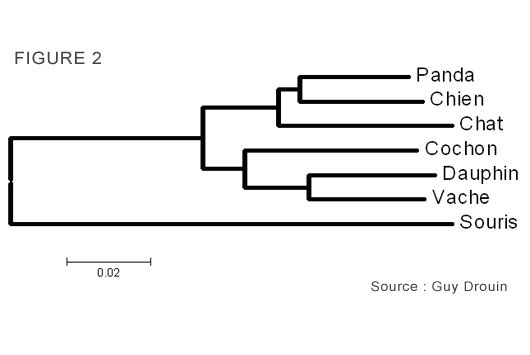 Par exemple, le mois dernier, nous avons discuté ici du fait que les ancêtres des baleines étaient des ongulés terrestres carnivores. Les baleines ont donc évolué énormément (un terme approprié pour les baleines!) tandis que les autres ongulés qui sont restés sur Terre ont beaucoup moins changé sur le plan morphologique. Par contre, si on regarde l’arbre phylogénétique ci-dessous, on voit que la quantité de changements d’acides aminés (représentée par la longueur des branches) est très similaire chez les vaches et les baleines (représentées par les dauphins dans cette figure). En fait, toutes les branches de cet arbre ont des longueurs très similaires. Ces espèces ont donc toutes accumulé un nombre similaire de mutations durant leur évolution.
Par exemple, le mois dernier, nous avons discuté ici du fait que les ancêtres des baleines étaient des ongulés terrestres carnivores. Les baleines ont donc évolué énormément (un terme approprié pour les baleines!) tandis que les autres ongulés qui sont restés sur Terre ont beaucoup moins changé sur le plan morphologique. Par contre, si on regarde l’arbre phylogénétique ci-dessous, on voit que la quantité de changements d’acides aminés (représentée par la longueur des branches) est très similaire chez les vaches et les baleines (représentées par les dauphins dans cette figure). En fait, toutes les branches de cet arbre ont des longueurs très similaires. Ces espèces ont donc toutes accumulé un nombre similaire de mutations durant leur évolution.Ceci est dû au fait que la majorité des mutations qui ont lieu dans l’ADN des organismes vivants sont neutres, c’est-à-dire qu’elles ne confèrent pas d’avantage ou de désavantage sélectif. Elles sont donc transmises aux générations suivantes à une vitesse égale au taux de mutation. Les données ci-dessous, constituées des séquences d’acides aminés utilisées dans la chronique du mois dernier, illustrent bien la nature de ces mutations neutres.

Dans la figure 3, on voit que le premier acide aminé de cette protéine peut être une arginine (R) ou une lysine (K). Si on consulte le code génétique ci-dessous, on constate que ces deux acides aminés sont tous deux chargés positivement. Les mutations qui ont changé la lysine en arginine, ou vice versa, sont donc des mutations neutres parce qu’elles n’ont pas affecté la fonction de cette protéine. La même chose s’applique à toutes les autres colonnes, comme les 4, 6 et 10, où les mutations ont simplement changé une proline pour une sérine, ou vice versa, deux acides aminés neutres polaires.

À l’opposé, la sélection naturelle élimine les mutations désavantageuses et favorise les mutations avantageuses. Ces types de mutations ne peuvent donc pas s’accumuler à un taux constant. Elles ne suivent pas une horloge moléculaire. Elles sont aussi beaucoup plus rares que les mutations neutres.
Le fait que la majorité des mutations sont neutres explique pourquoi l’horloge moléculaire existe et fonctionne relativement bien. En fait, les généticiens s’en servent souvent pour dater les temps de divergence entre des espèces, mais aussi pour dater des évènements aussi divers que le temps d’origine du SIDA et celui de l’invention des vêtements. Mais ça, c’est le sujet de la chronique du mois prochain!
Autres articles de cette série Parce qu'on évolue
- Bienfaits du sexe, méfaits du cousinage
- Les baleines, ces vaches qui ont pris la mer
- Notre corps « patenté »
- Domestiquer, c’est sélectionner
- Mutations... on n'a encore rien vu!
- Nos yeux « broche à foin »
- Notre corps « patenté »
- Évoluer en compagnie des bêtes et des plantes
- FOXP2, le gène du langage
- Le diabète : une adaptation qui a mal tourné?
- Poux ou virus : la datation par les gènes
- Haplotypes ou comment on reconnaît nos mutations utiles
- Vivre sans le gène de la vitamine C
- À l'heure de l'horloge moléculaire
- Vous êtes génétiquement unique
- Les mutants « buveurs » de lait
- Évolution en beauté
- Nu au soleil
- Guy Drouin
Université d'Ottawa
Guy Drouin est professeur titulaire à l’Université d’Ottawa depuis 1990. Il détient un doctorat en génétique de l’Université de Cambridge, et il a poursuivi ses études postdoctorales à l’Université Harvard. Ses recherches portent sur l’évolution des gènes et des génomes. Il enseigne la génétique, l’évolution moléculaire et la génétique évolutive des humains. Il s’intéresse aussi à l’enseignement des sciences en milieu minoritaire.
Note de la rédaction : Les textes publiés et les opinions exprimées dans Découvrir n'engagent que les auteurs, et ne représentent pas nécessairement les positions de l’Acfas.
Vous aimez cet article?
Soutenez l’importance de la recherche en devenant membre de l’Acfas.
Devenir membre
Commentaires
Articles suggérés

Infolettre



