Nous avons découvert qu'en ciblant directement les cellules du "grippé", et non le virus, son organisme se défendrait efficacement sans encourager l’apparition de virus résistants. De plus, cela semble fonctionner avec différentes souches...
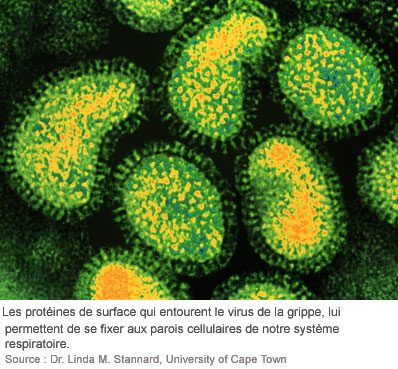 L’ennemi : l'influenza A
L’ennemi : l'influenza A
L'influenza A est le principal agent causal des épidémies saisonnières de grippe et des pandémies, et son mode de transmission est essentiellement respiratoire. En éternuant, en toussant ou en parlant, nous projetons un « bioaérosol » composé de millions de minuscules gouttelettes habitées de virus. Toute personne reniflant cette bruine, embrassant un porteur virulent ou risquant une poignée biocontaminée – de porte ou de main! – risque l’infection. Ainsi, avec la joie des premières chutes de neige s’amène l'hiver et se déclare la grippe...
Cette infection respiratoire extrêmement contagieuse affecte de 10 à 25 % de la population canadienne. Généralement bénigne, elle peut aussi être fatale; de 3000 à 5000 Canadiens en meurent chaque année. On a bien sûr développé une contre-offensive assez puissante à coups de vaccins et de médicaments antiviraux. Un jeu cependant auquel on peut difficilement gagner tant le virus combine efficacement quantité de variations et rapidité de mutation. Les pandémies nous pendent toujours au bout du nez…
Une nouvelle tactique toutefois pourrait réussir à déjouer l’ennemi : au lieu de l’attaquer directement, on jouerait les filous en munissant l’hôte de bonnes défenses.
De variations en mutations
Les premiers examens génétiques, il y a quelques décennies, ne laissaient pas prévoir que ce simple germe aurait une telle puissance de nuisance, puisqu’il se résume à huit segments d'ARN entourés d’une enveloppe lipidique parsemée de deux glycoprotéines : l'hémagglutinine (HA) et la neuraminidase (N).
Les choses se sont compliquées quand on a découvert1, à la fin des années 1970, qu'il possédait plusieurs variantes de protéines d'hémagglutinine (HA) et de neuraminidase (N). À ce jour, les chercheurs ont identifié 17 HA et 9 N. De ce fait, une simple multiplication nous met face à 159 variantes, dont les fameux H1N1 et H5N1.
De plus, grâce à sa grande faculté de mutation, ce virus se joue de la vaccination et des antiviraux. Une entité « intelligente », se plaisent à dire certains chercheurs. D'ailleurs, l'une des craintes de la communauté scientifique et médicale est l'apparition d'une « super » variante du virus H1N1 plus virulente que celui de la grippe espagnole.
L’attaque directe sur le virus
Notre riposte thérapeutique contre la grippe repose présentement sur le ciblage direct du virus de l'influenza A. On peut d’abord agir avant la menace au moyen des vaccins. Chaque année, des millions de personnes sont vaccinées contre la souche virale de l'année précédente. En injectant le virus entier, mais atténué, ou une partie du virus accompagné d’un adjuvant, on amène le système immunitaire à construire ses défenses.
Ensuite, une fois que le virus est entré et se multiplie joyeusement dans notre système, on utilise les antiviraux tels que l'OseltamivirMD, mieux connu sous le nom de TamifluMD. L’approche consiste alors à emprisonner les virions2 dans les cellules infectées en bloquant l’enzyme indispensable à leur évasion, la neuraminidase virale. La propagation est alors arrêtée.
Toutefois, si l'efficacité de ces deux approches est indéniable, elles ne sont pas sans failles.
L'efficacité des vaccins et des antiviraux est indéniable, mais loin d'être sans failles.
La faiblesse des vaccins : toujours à refaire
Chaque vaccin est préparé à partir de la souche de l'année précédente tandis que chaque grippe saisonnière est causée par une variante. Par conséquent, il faut chaque année renouveler et mettre à jour les stocks de vaccins, ce qui coûte cher. De plus, entre le développement d'un vaccin et sa commercialisation, un long processus de tests s’étale entre six et douze mois; un délai risqué s’il y a émergence d'une pandémie similaire à la grippe espagnole ou plus complexe.
La faiblesse des antiviraux : la résistance
L'histoire récente nous l'a confirmé : les virus mutent tellement vite qu'ils arrivent à développer une résistance contre les antiviraux. L'exemple du TamifluMD est assez frappant.
Le TamifluMD est pris en charge par le foie, où il est recyclé, en partie, en principe actif avant de se retrouver partout dans le corps… et forcément aussi dans les eaux usées. Ces eaux sont fréquentées dans beaucoup de pays par des volailles infectées par le virus de la grippe; la probabilité de l'apparition d'une résistance chez ces animaux, dans ce cas, est très sérieuse. En outre, le producteur du vaccin lui-même, à savoir la firme Roche, a déjà sonné l'alarme, puisqu’il a rapporté au moins depuis 2004 l'apparition de plusieurs mutants du virus H1N1 et de H5N1 résistants au TamifluMD.
Au vu de toutes ces données, on ne peut se contenter de nos acquis, vaccins et antiviraux. Il faut, à mon avis, avoir le courage de chambouler les idées et réfléchir à de nouvelles méthodes de traitement de masse, plus simples, moins coûteuses et avec de faibles probabilités de développement de résistance.
Nous sommes complices du virus
Il faut penser notre système respiratoire comme une grande surface accessible aux « bioaérosols », dont le virus de la grippe. C’est à partir de ce terrain de choix que l'influenza A fera son entrée, notre corps lui fournissant les clés...
Une fois respiré, on peut imaginer le virus frôlant les parois de notre gorge, une surface riche en enzymes appelées protéases. Ces dernières sont une « clé » qui pouvant « ouvrir » les protéines de surface du virus HA. De cette rencontre résulte l'ouverture de la porte HA, qui se scinde alors en deux sous-unités (HA1 et HA2).
Bingo! Le virus peut maintenant se fixer avec sa HA1 à la membrane de la cellule. Celle-ci réagit immédiatement à ce corps étranger et l’absorbe pour le détruire, mais, ce faisant, le virus se transforme de manière telle qu’il se soude plutôt aux molécules de la membrane et perd son statut d’immigrant. Il se dirige alors vers la machinerie du noyau de la cellule pour lui voler le matériel génétique dont il a besoin pour se reproduire et ressortir de la cellule...
L'attaque indirecte pour tromper le virus
Il y a quelques années, l'équipe avec laquelle je collaborais a pris connaissance d'études soulignant que ces protéases des tissus respiratoires étaient aussi impliquées dans l'activation d'une famille de récepteurs appelés PAR (Proteases Activated Receptors) et connus pour contribuer à la modulation de notre système immunitaire. Ce travail a été réalisé au sein de l'Unité de virologie et immunologie moléculaire de l'INRA de Jouy-en-Josas et au Laboratoire dev irologie et pathologie de l'Université de Lyon 1, sous la direction du Dr Béatrice Riteau.
Bref, parmi les études, en 2004, Rommel S. Lan et ses collaborateurs de l’Université Western Australia ont rapporté pour la première fois que le virus H1N1 pouvait moduler positivement la famille des récepteurs PAR, particulièrement le PAR-1, qui se trouvent en abondance, entre autres, à la surface de l’épithélium respiratoire. Prenant conscience, que les virus avaient sans doute besoin de ces récepteurs, nous avons donc décidé d'étudier in vivo le rôle de PAR-1 dans la pathologie de H1N1, afin de voir si l’on ne pouvait pas couper « l’herbe sous le pied » du pathogène.

Dans le labo...
Nous avons d'abord exposé par voie nasale un premier groupe de souris à une solution contenant le virus. Ensuite, nous avons ciblé le récepteur PAR-1 tantôt en l’activant avec un agoniste, tantôt en le bloquant avec un antagoniste.
Au bout de sept jours, 60 % des souris du groupe exposé à un récepteur PAR-1 activé étaient mortes, et seulement 10 % pour le groupe contrôle. À l'inverse, 100 % du groupe traité avec le bloqueur de PAR-1 avait survécu à l'infection, et 50 % pour le groupe contrôle. Ces résultats confirmaient pour la première fois que le récepteur PAR-1 augmente la sensibilité de l'hôte vis-à-vis du virus H1N1, et que si on le bloque, la « bête » perd ses moyens de nuisance ou de virulence.
Poursuivant nos expériences pour bien asseoir ces résultats, nous avons infecté des souris génétiquement modifiées où le récepteur PAR-1 ne s’exprime pas du tout; 95 % de ces souris dites PAR-1 « KO » ont survécu au virus H1N1, contre 25 % seulement pour les souris dites « sauvages », qui, elles, expriment le PAR-1.
Les résultats obtenus étaient donc sans appel quant au rôle délétère de PAR-1 dans un contexte de grippe. De plus, cette efficacité thérapeutique n'était pas spécifique au sous-type H1N1, mais touchait aussi les souches les plus virulentes tels le virus H3N2 de la grippe de Hong Kong et le virus aviaire, le H5N1.
Un traitement révolutionnaire?
Ces résultats confirment donc pour la première fois que la conception d’un traitement alternatif de la stratégie classique avec peu de probabilités d'émergence d'une résistance est possible. De fait, comme on ne vise pas le virus directement, il n’a pas les «informations» nécessaires pour développer une résistance.
La conception d’un traitement alternatif de la stratégie classique avec peu de probabilités d'émergence d'une résistance est donc possible.
Des antagonistes ou bloqueurs de PAR-1 sont actuellement en phase III d’essais cliniques pour d'autres pathologies. De ce fait, et en raison des connaissances déjà emmagasinés sur les potentiels effets secondaires de cette molécule, l'utilisation du l’antagoniste appelé SCH79797 pour le traitement de la grippe devrait être pour bientôt. Plusieurs firmes pharmaceutiques ont d’ailleurs montré leur intérêt pour cette approche thérapeutique. Une stratégie favorisant l’action ciblée sur la réponse immunitaire de l’hôte plutôt que sur le virus lui-même représente une piste inédite face aux virus résistant aux traitements actuels ou aux virus fortement pathogènes.
Article scientifique :
- Khoufache K et al., « PAR1 contributes to influenza A virus pathogenicity in mice », The Journal of Clinical Investigation, 2013.
Brevet :
Notes :
- 1. Organisation mondiale de la santé (OMS), 1980. Ce fut là le début d'un consensus pour la nomenclature des sous-types de virus de l'influenza A.
- 2. « Les virus existent sous une forme extra-cellulaire (unité matérielle indépendante appelée alors virion) ou intra-cellulaire (virus intégré sous forme dormante ou détournant activement la machinerie cellulaire au profit de sa réplication). Sous la forme intracellulaire (à l'intérieur de la cellule hôte), les virus sont des éléments génétiques qui peuvent se répliquer de façon indépendante par rapport au chromosome, mais non indépendamment de la cellule hôte. Sous la forme extracellulaire, les virus sont des objets particulaires, infectieux, constitués au minimum d'un acide nucléique englobé dans une capside de protéines », Wikipédia.
- Khaled Khoufache
Université Laval
Après des études de biochimie en Algérie, Khaled Khoufache effectue une maîtrise (2002) et un doctorat (2006). Il est ainsi Docteur en Interactions Hôte - Parasites de la Faculté de médecine de Créteil, Université Paris XII. En 2010, il termine un premier postdoctorat sur le virus de l’influenza à l’Institut INRA à Paris et reçoit le grade de maître de conférences des universités françaises. Il est présentement postdoctorant à l’Université Laval. Il a reçu plusieurs récompenses, dont le premier prix de virologie à la 29e Réunion interdisciplinaire de chimiothérapie anti-infectieuse (RICAI) au Palais des congrès, à Paris, en 2009.
Vous aimez cet article?
Soutenez l’importance de la recherche en devenant membre de l’Acfas.
Devenir membre
Vous pourriez aimer aussi
Commentaires
Articles suggérés

Infolettre



